永利官网
Cell Reports | 梁静课题组与合作者发现PD-L1固有转录抑制缺失在三阴性乳腺癌免疫逃逸中的新机制
2023年月日,yl9193永利梁静研究员团队联合北京大学人民医院王殊教授团队在Cell Reports杂志上在线发表题为“PD-L1-Mediated Immune Evasion in Triple-Negative Breast Cancer Is Linked to the Loss of ZNF652”的研究论文,报道了PD-L1的固有转录抑制因子锌指蛋白ZNF652表达缺失是导致三阴性乳腺癌发生免疫逃逸的重要机制。

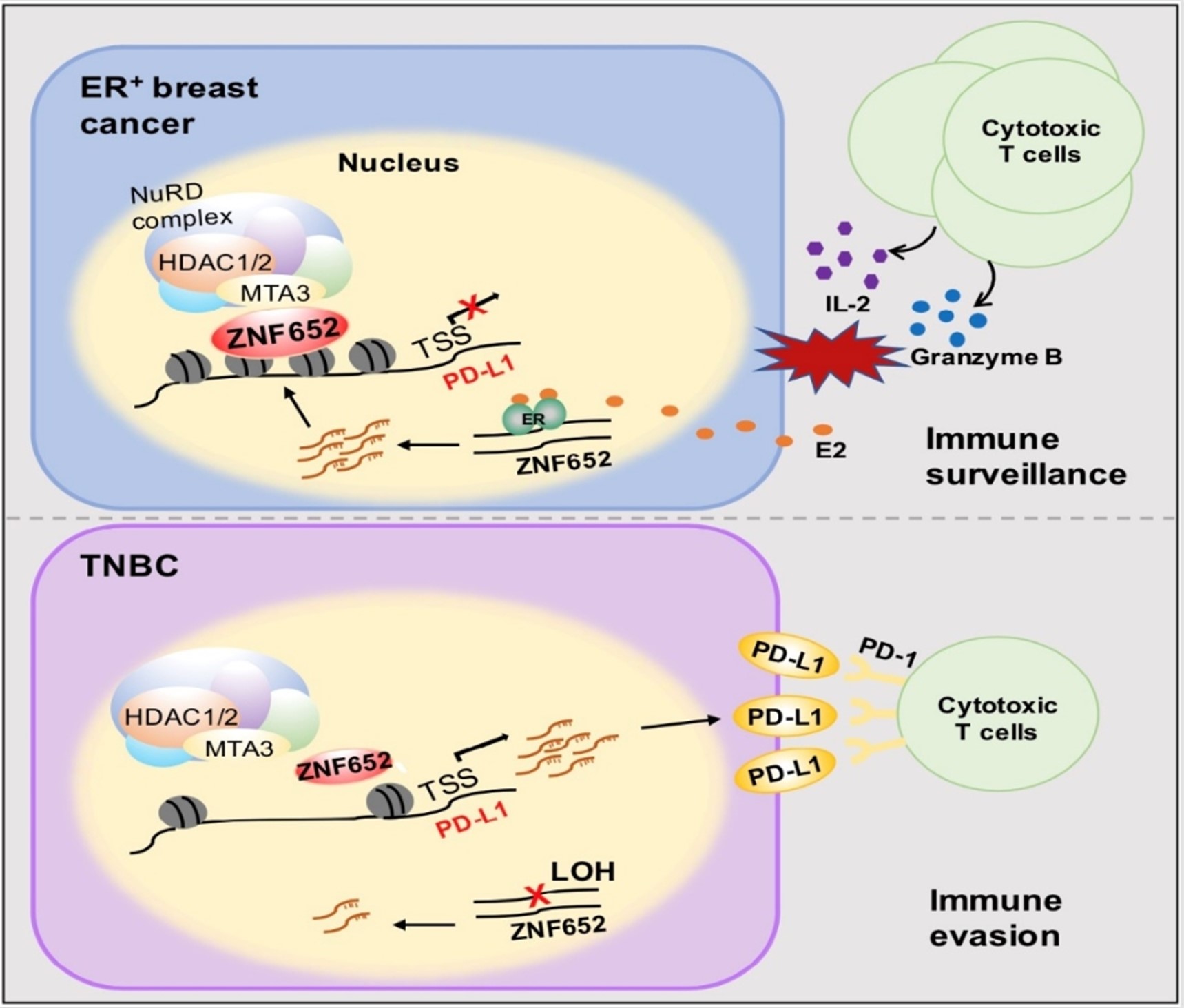
近年来,免疫检查点抑制剂的蓬勃发展使得肿瘤治疗策略发生了根本性变革。程序性死亡配体1(programmed death ligand-1, PD-L1),能够与微环境中T细胞表面的程序性细胞死亡蛋白1(programmed cell death protein 1, PD-1)结合,抑制T细胞的增殖及其杀伤作用,是癌细胞逃避免疫系统监管的核心机制。由于存在原发及继发性耐药,抗PD-1/PD-L1治疗的总体应答率仍然较低。肿瘤细胞的PD-L1表达水平与抗PD-1/PD-L1疗效密切相关,因此,深入了解PD-L1的表达调控机制对肿瘤免疫治疗至关重要。在不同肿瘤细胞中,一系列炎性因子及信号转导通路可在转录水平激活PD-L1的表达。然而,关于PD-L1的固有转录抑制因子及其如何参与肿瘤发生发展未曾被发现。
ZNF652属于C2H2型锌指蛋白家族成员,具有DNA结合能力。ZNF652基因位于17号染色体长臂2区1带3亚带(17q21.3),该区域还包含经典的肿瘤抑制基因BRCA1。研究者首先分析了TCGA数据库中包含33种肿瘤类型的10,522例患者样本中ZNF652的拷贝数情况,发现ZNF652在多种肿瘤中易发生染色体杂合性缺失(loss of heterozygosity, LOH),其中包括乳腺癌。在恶性程度较高的三阴性乳腺癌(triple-negative breast cancer, TNBC)中,ZNF652具有极高的缺失频率。研究者进而搜集了111例的不同分子亚型的临床乳腺癌组织样本(luminal A、luminal B、HER2+和TNBC),并对ZNF652基因座周围NA进行PCR多态性片段分析,结果同样表明ZNF652在TNBC中存在高频缺失。研究者进一步对UCSCXena和TCGA数据库进行了乳腺癌组织基因组和转录组的整合分析,证明ZNF652的mRNA水平与其DNA片段LOH程度呈负相关。此外,ZNF652的表达还受到上游雌激素-雌激素受体信号通路的转录激活调控。因此,ZNF652在TNBC中的表达缺失受到基因水平和转录水平的共同影响。
研究者进而在乳腺癌细胞中进行了蛋白质谱检测,并通过免疫共沉淀、GST pull-down、快速蛋白质液相色谱等多种方法,发现ZNF652与包含HDAC1/2的核小体重塑和去乙酰化酶(nucleosome remodeling and deacetylase, NuRD)复合体具有直接相互作用。通过全基因组范围的染色质免疫沉淀ChIP-seq及RNA-seq联合分析,研究者鉴定了ZNF652-NuRD复合物的内源靶点,证明其富集在基因启动子区并抑制一系列肿瘤相关的靶基因转录,其中包括PD-L1。通过构建一系列基因过表达、基因敲减、及基因敲除的人源/小鼠源乳腺癌细胞系,研究者从分子、细胞、及动物水平对ZNF652-NuRD复合体转录抑制PD-L1的全能性和高效性进行了检测及验证,证明TNBC中ZNF652的表达缺失引发PD-L1高表达,进而促使癌细胞发生免疫逃逸,加速肿瘤进展。值得注意的是,动物实验表明尽管组蛋白去乙酰化酶HDAC1/2参与抑制PD-L1,这种机制与HDAC1/2抑制剂罗米地辛的抗癌功能并不关联。研究者进一步对临床乳腺癌患者的样本进行了分析,结果显示ZNF652的表达降低与PD-L1表达升高、杀伤性T细胞浸润减少及乳腺癌患者预后不良具有显著相关性。此外,ZNF652对PD-L1的转录抑制作用在肾癌、非小细胞肺癌等肿瘤中也具有一定普适性。
综上,本研究首次鉴定了免疫检查点分子PD-L1的一个固有转录抑制因子ZNF652,并阐明了ZNF652表达缺失在TNBC发生免疫逃逸中的机制。该工作为全面理解细胞内PD-L1的复杂调控提供了新视角,也为肿瘤免疫治疗提供了新的疗效及预后评估生物学指标。
yl9193永利博士研究生刘运成为本文的第一作者。北京大学人民医院乳腺中心彭媛医生、杜炜医生、杭州师范大学余春雨博士为本文做出重要贡献。yl9193永利梁静研究员和北京大学人民医院乳腺中心王殊教授为该论文的共同通讯作者。yl9193永利为第一完成单位。yl9193永利/杭州师范大学尚永丰院士和中国医学科学院肿瘤医院刘芝华研究员为本研究提供协助,yl9193永利病理系柳剑英主任医师和北京大学系统生物医学研究所蛋白质和代谢组学平台为本研究提供技术支持。这项工作受到科技部重点研发计划、国家自然科学基金面上项目和基础中心项目等基金资助。
原文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(23)01355-4

