永利官网
EMBO J | 尹玉新团队揭示E3泛素连接酶CRL2FEM1B多聚化及其发挥功能的结构基础
泛素-蛋白酶体系统是真核细胞内重要而精细的蛋白质稳态控制系统的核心组成部分之一。蛋白质泛素化降解过程主要通过三大关键酶类的精密协作来实施,即“泛素激活酶”(E1)、“泛素结合酶”(E2)以及“泛素连接酶”(E3)。整个泛素化过程之中,E3连接酶的角色至关重要,它负责识别特定底物,并将泛素转移到底物上。Cullin-RING E3泛素连接酶(CRLs)是一类由催化亚基RBX、支架蛋白Cullin、底物适配蛋白和底物识别蛋白共同组装而成的多亚基复合体。Cullin-RING E3泛素连接酶家族成员在广泛的生物学进程和疾病中发挥着决定性作用,包括但不限于细胞增殖和还原性应激反应。在泛素-蛋白酶体系统(UPS)运作机制中,CRLs提供了一个多聚泛素化的平台,在这个平台上,底物特异地结合至底物识别蛋白,E2-泛素被导向至催化亚基RBX。值得注意的是,位于支架蛋白CullinN端的底物识别蛋白与其C端的催化亚基RBX之间的物理距离约为10纳米。CRLs如何有效地跨越这10纳米的空间将泛素从催化亚基转移至底物上,其详细的分子机制仍是一个有待揭示的谜团。因此,深入探究CRLs针对不同尺寸底物所采用的不同泛素化策略,将极大地促进我们对泛素化过程本质的认知。
近日,yl9193永利系统生物医学研究所尹玉新教授团队在国际知名期刊The EMBO Journal上发表了题为“Structural Insights into the Ubiquitylation Strategy of the Oligomeric CRL2FEM1B E3 Ubiquitin Ligase”的文章,首次报道了多聚形态E3泛素连接酶CRL2FEM1B在NEDD8修饰激活前,NEDD8修饰激活后与小分子量底物BEX2结合以及NEDD8修饰激活后与大分子量底物FNIP1/FLCN复合物结合的冷冻电镜结构,从而阐明了多聚化对于CRL2FEM1B针对不同尺寸底物执行泛素化修饰的结构基础。

该研究首先解析了未经NEDD8修饰(自抑制状态)时CRL2FEM1B三聚体的冷冻电镜结构,其中原体1作为支架稳定地锚定住原体2的两端,随后原体3按照与原体2“头对尾”的方式整合进三聚体结构中。通过质量光谱学(Mass Photometry)等多种技术手段确认,NEDD8修饰使CRL2FEM1B从三聚体转变为二聚体。研究进一步解析了经NEDD8修饰激活后CRL2FEM1B二聚体与底物BEX2结合的三维结构。结果显示,被NEDD8修饰激活的CRL2FEM1B二聚体展现出与自抑制状态下的原体1和原体2相似的构象。在这种构象中,原体1为底物的识别提供了底物识别亚基,而原体2则贡献了泛素化反应所需的催化亚基。相较于CRL2FEM1B单体,这种构象有效缩短了催化亚基与底物识别亚基之间的距离,使得泛素化效率得到显著提升。通过突变实验和体外泛素化反应验证,证实了此种构象确实能大幅提升对小分子量底物BEX2的泛素化效率。
此外还解析了NEDD8修饰后CRL2FEM1B与大分子量底物FNIP1/FLCN复合物结合的结构,并结合生化实验发现,FNIP1/FLCN复合物促使NEDD8激活后的CRL2FEM1B二聚体进一步解聚,然后通过多个位点的相互作用结合在CRL2FEM1B的催化亚基与底物识别亚基之间,确保泛素得以顺利地催化连接至底物上。
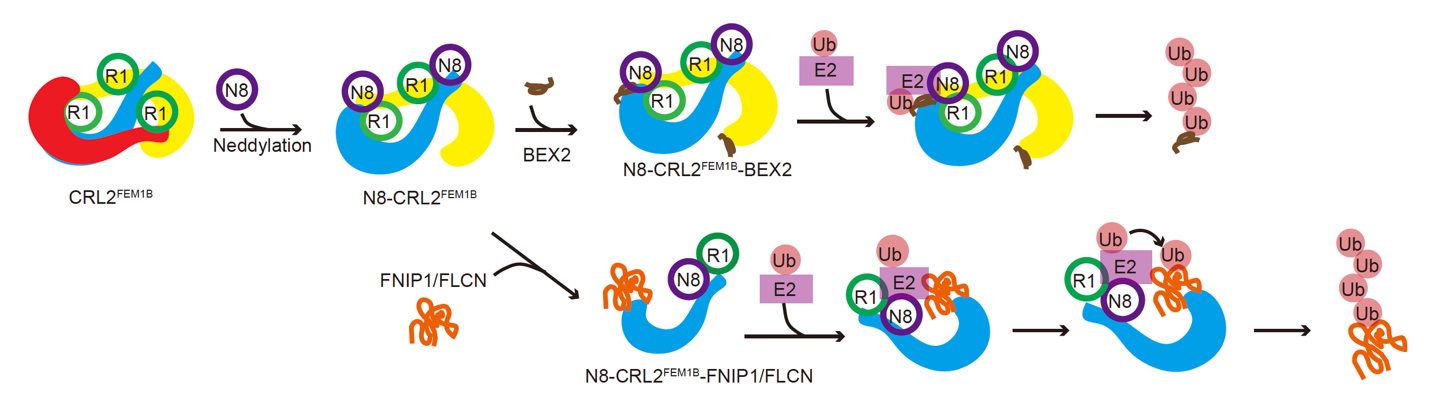
CRL2FEM1B识别不同底物及激活的模式图
综上所述,此项研究通过对不同状态下CRL2FEM1B结构的深入解析,揭示了多聚化CRL2FEM1B泛素连接酶针对不同尺寸底物的泛素化策略,完善了对CRLs泛素连接酶工作机理的认识,同时也为设计针对此类泛素连接酶的PROTAC药物提供了坚实的结构生物学依据。
北京大学系统生物医学研究所尹玉新教授为该文章的通讯作者。yl9193永利博士研究生戴宗林、yl9193永利副研究员梁令和北大-清华生命科学联合中心博士研究生王伟泽为论文的共同第一作者。yl9193永利博士研究生佐鹏和於尚为相关研究做出了重要贡献。
该研究得到国家重点研发计划和国家自然科学基金以及北大-清华生命科学联合中心的支持。
原文链接:
https://doi.org/10.1038/s44318-024-00047-y

