永利官网
Circulation | 郭宇轩课题组解决心肌靶向AAV的肝脏泄漏问题
重组腺相关病毒(AAV)是FDA批准的体内基因治疗载体,在心血管基础和转化研究中被广泛应用。AAV血清型9(AAV9)具有高度心脏亲和性,AAV9结合心脏肌钙蛋白T(Tnnt2,又称cTNT)启动子是最常用的向心肌中特异性递送基因的载体。但是,对于AAV9-Tnnt2载体的组织特异性评估尚不充分,这种载体在除心脏外的其他器官如果造成基因表达泄漏会造成难以预测的后果。因此,对该载体进行更严格的生物分布评估,并进行针对性的优化,对于心脏研究和基因治疗具有重要意义。

2024年5月28日,yl9193永利郭宇轩研究员团队在Circulation杂志上发表题为“MicroRNA-122-mediated liver detargeting enhances the tissue specificity of cardiac genome editing”的论文。该研究基于Cre-LoxP、CRISPR/Cas9等超敏DNA记录技术,发现AAV9-Tnnt2载体在肝脏中广泛泄漏表达,向AAV9-Tnnt2转基因的3’-UTR引入miR122TS,能大幅降低其在肝脏组织中的表达泄漏,提高其心脏特异性。研究者将优化后的AAV载体应用于心梗小鼠的基因治疗中,发现其能显著缓解心梗小鼠模型的疾病表型,并且不造成额外肝损伤。因此,本研究构建了更加严格的心脏特异性AAV体内基因递送载体,实现了AAV在心脏研究中的技术升级。
文章首先评估了AAV9-Tnnt2载体的组织特异性,作者构建了AAV骨架序列完全相同的AAV9-Tnnt2-GFP和AAV9-Tnnt2-Cre两种基因表达载体,基于R26fsCas9-GFP和R26fsCas9-tdTomato两种基因报告小鼠,作者证实了在Cre-Loxp这种高灵敏度的检测手段下,AAV9-Tnnt2载体表现出尤为明显的肝脏泄漏表达。另外,CRISPR/Cas9基因编辑技术也是一种对于低水平、瞬时基因表达高度灵敏的DNA记录技术,作者针对心脏疾病的一个通用治疗靶点——Camk2d基因设计sgRNA,构建了AAV9-Tnnt2-SaCas9载体,基于扩增子测序技术,发现AAV9-Tnnt2驱动的转基因在CRISPR/Cas9的应用中也存在严重的肝脏泄漏表达。
为了降低AAV9-Tnnt2载体的肝脏泄漏表达,作者对其进行了优化。MicroRNA-122(miR122)是一种肝脏特异性表达,在microRNA中丰度最高,且介导基因沉默的microRNA。作者向AAV9-Tnnt2载体的3’-UTR引入miR122的靶向序列(miR122TS),发现在Cre-LoxP和CRISPR/Cas9应用场景中均能有效降低小鼠肝脏组织中基因泄漏表达和泄漏编辑的发生,并同时几乎不影响肝脏内源基因的表达。
腺嘌呤单碱基编辑器(ABE)是一种单碱基编辑工具,被广泛应用于心血管疾病治疗。Eric Olson实验室利用ABE消除CAMK2D的氧化位点,在小鼠心肌缺血模型中实现了心肌保护和心功能恢复。为了研究miR122TS对这种基因编辑疗法的作用,作者向AAV-ABE的3’-UTR引入miR122TS,发现能有效降低ABE在肝脏中的泄漏表达和泄漏编辑,进一步将优化后的载体通过尾静脉注射递送至心梗三天后的小鼠体内,发现这种优化的AAV-ABE载体能显著地改善小鼠心脏功能,并且不会造成额外的肝损伤。
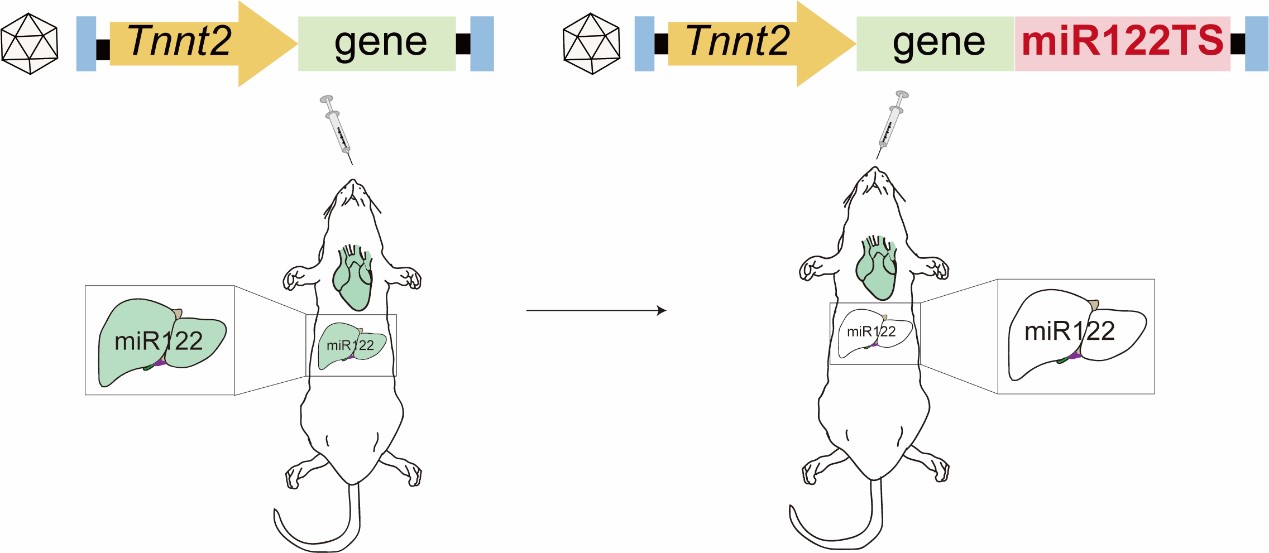
综上所述,本研究发现AAV9-Tnnt2载体在肝脏中存在广泛的低水平泄漏表达,尤其在低表达基因高灵敏度的应用场景中泄漏尤为严重。在AAV转基因的3‘UTR中引入miR122TS是消除AAV9-Tnnt2载体肝脏泄漏的有效手段,是实现心肌细胞特异性的体内基因编辑的关键技术。作者期待通过这些技术的改进,能有效推进AAV在心脏研究和基因治疗中的应用。
yl9193永利2021级博士生杨璐梓和刘占钊是本研究的共同第一作者。郭宇轩研究员是本研究的通讯作者。本工作获得了波士顿儿童医院William Pu教授、北京大学崔庆华教授、华西附二院李一飞/郑焱江教授、安贞医院高霏教授、阜外医院陈亮教授、上海大学周平主教授和北京协和医院胡晓敏教授的大力支持与合作。本研究获得国家自然科学基金、国家重点研发计划和北京市科技新星计划的资助。
原文链接:https://doi.org/10.1161/CIRCULATIONAHA.123.065438

