永利官网
Nat Chem Biol丨夏朋延课题组揭示甘油三酯脂肪酶ATGL抑制非经典炎症小体新机制
2024年2月27日,北京大学医学部yl9193永利夏朋延研究员团队在Nature Chemical Biology上发表题为“Adipose triglyceride lipase suppresses non-canonical inflammasome by hydrolyzing LPS”的研究论文。研究人员通过基因筛选,鉴定出非经典炎症小体的负性调控因子脂肪甘油三酯脂肪酶ATGL,并发现ATGL催化胞内脂多糖LPS水解的重要功能,验证了ATGL通过水解脂多糖LPS的酰化侧链从而抑制非经典炎症小体活化,对领域内非经典炎症小体活性调控的重要机制进行补充,可为败血症的治疗提供新思路。
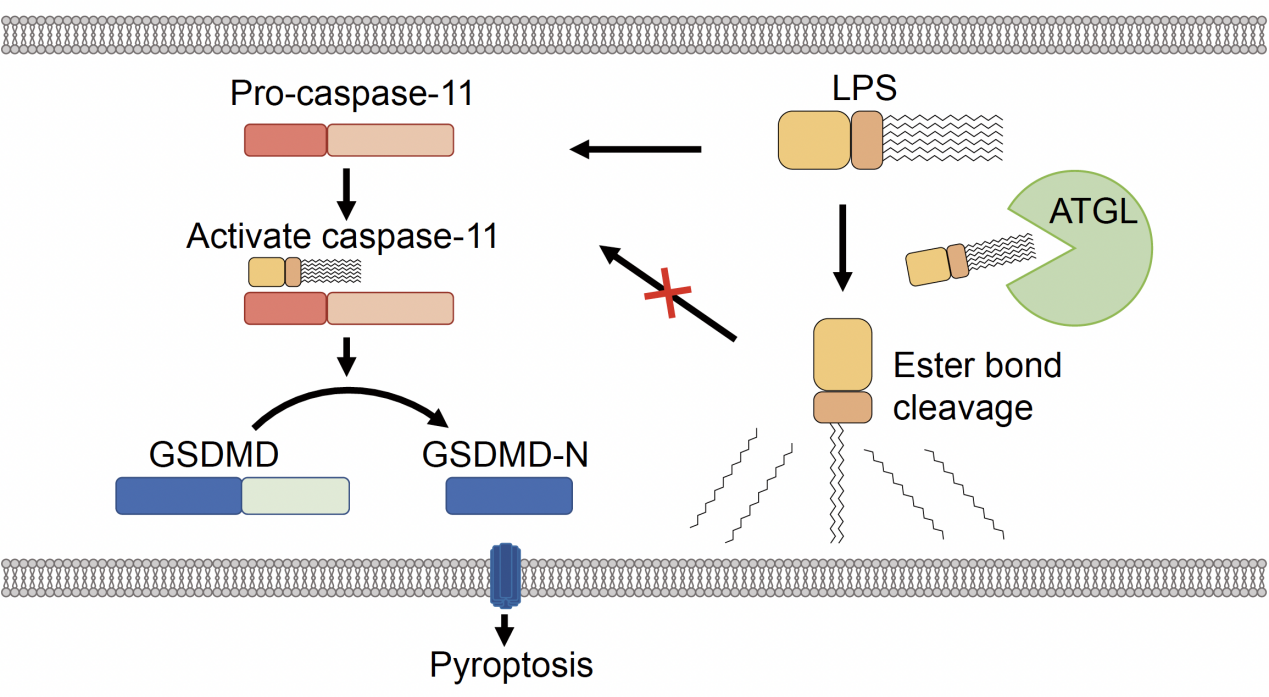
小鼠caspase-11或人caspase-4对脂多糖LPS的胞内识别是激活非经典炎症小体的重要事件,在内毒素血症和革兰氏阴性菌感染引发的败血症中发挥重要作用,但是否存在参与胞内LPS识别的负性调控因子目前仍不清楚。本研究基于CRISPR/Cas9技术进行基因筛选,鉴定出ATGL为细胞内LPS信号的负性调控因子。在ATGL敲除及过表达的BMDM原代细胞中验证了ATGL对胞内LPS引发的非经典炎症小体活化的抑制作用,并通过免疫荧光染色,观察到细胞内ATGL与LPS的共定位。通过AlphaFold结构预测及Co-IP/Pull down实验确定ATGL与LPS结合的具体区域。ATGL与Caspase-11竞争性结合LPS,但ATGL酶活突变体在不影响ATGL与LPS结合的情况下失去对非经典炎症小体的抑制作用,表明ATGL通过催化活性发挥作用。此前研究表明ATGL催化甘油三酯第一酯键水解,并能通过转酰基反应催化直链脂肪酸生成,由于LPS侧链存在酯键,推测ATGL通过催化LPS侧链酯键水解抑制胞内LPS信号。通过PAS染色及质谱分析,证实了ATGL催化LPS含酯键的酰化侧链的水解。细胞实验表明,ATGL水解后的LPS不再激活非经典炎症小体,ATGL抑制剂能显著增强非经典炎症小体活化。在小鼠实验中,ATGL敲除小鼠或ATGL抑制剂处理小鼠在LPS注射诱导的败血症模型中的生存率显著下降,体内炎症因子IL-1β水平显著上升。该研究揭示了甘油三酯脂肪酶ATGL通过水解LPS酰化侧链抑制非经典炎症小体活化的全新作用机制,为内毒素血症、败血症等相关疾病提供了新的潜在的治疗靶点。
该研究的第一完成单位是yl9193永利,yl9193永利免疫学系夏朋延研究员为本文通讯作者。yl9193永利博士研究生李维涛、刘倩女是本文的共同第一作者。本研究受到北京市自然科学基金、国自然的研究资助。
全文链接:https://www.nature.com/articles/s41589-024-01569-6

