永利官网
Molecular Cell |yl9193永利孙露洋团队揭示蛋白酶体组分PSMD14驱动 多发性骨髓瘤发生发展的表观调控机制
2023年11月7日,yl9193永利孙露洋教授团队在Molecular Cell杂志在线发表题为“The Proteasome Component PSMD14 Drives Myelomagenesis through a Histone Deubiquitinase Activity”的研究论文,揭示蛋白酶体组分PSMD14是一个新的组蛋白H2AK119去泛素化酶,与组蛋白H3K36二甲基转移酶NSD2在染色质上互作,并促进H3K36二甲基的发生,进而导致染色质可及性升高和癌性基因的转录激活;PSMD14不仅可以增加t(4;14)骨髓瘤患者预后的风险分层,还是克服硼替佐米耐药的潜在干预靶点。

多发性骨髓瘤(Multiple myeloma) 是仅次于淋巴瘤第二高发的血液系统恶性肿瘤,其典型特征为骨髓内浆细胞克隆性恶性增生。半数以上的多发性骨髓瘤患者14号染色体上免疫球蛋白重链(IgH)存在易位,被认为是骨髓瘤发生的驱动事件。其中t(4;14)易位导致组蛋白甲基转移酶NSD2异常高表达,该类患者属于中高危基因型,然而患者间疾病进程和预后差别大,亟待进一步的分子分层。
26S蛋白酶体包含一个20S核心颗粒和两个19S调节颗粒。20S核心颗粒的抑制剂硼替佐米自2003年被FDA批准用于多发性骨髓瘤的治疗,至今仍是一线用药。然而绝大部分患者不可避免地耐药复发和进展,近年来19S调节颗粒成为克服硼替佐米耐药的热门靶点。有研究表明抑制19S调节颗粒的固有组分PSMD14呈现抗肿瘤作用,但并不能通过选择性抑制蛋白酶体活性来解释,这暗示PSMD14存在蛋白酶体非依赖的功能。
研究人员首先从多发性骨髓瘤细胞的不同亚细胞组分中,质谱检测了PSMD14的蛋白互作组,发现PSMD14在细胞质中与已知的19S调节颗粒组分结合,同时还存在于染色质组分中,并与组蛋白H3K36甲基转移酶NSD2发生相互作用。稳定同位素标记的定量蛋白质组学结果和体内/体外酶活实验表明,PSMD14具有组蛋白H2AK119去泛素化酶活性,并能促进NSD2介导的H3K36二甲基化的发生,证明PSMD14/NSD2是一个新的表观修饰复合体。

图1. 戴皇冠的黑、白天鹅分别代表在染色质上和蛋白酶体中的PSMD14
随后,表观组学研究结果表明PSMD14与NSD2通过各自的酶活,共同激活包括转录因子RELA在内的参与多发性骨髓瘤发生发展的重要基因的转录。同时RELA能够反过来结合在PSMD14基因的启动子区,继而转录激活PSMD14的表达,形成的PSMD14/NSD2-RELA正反馈环路,驱动多发性骨髓瘤的发生发展。
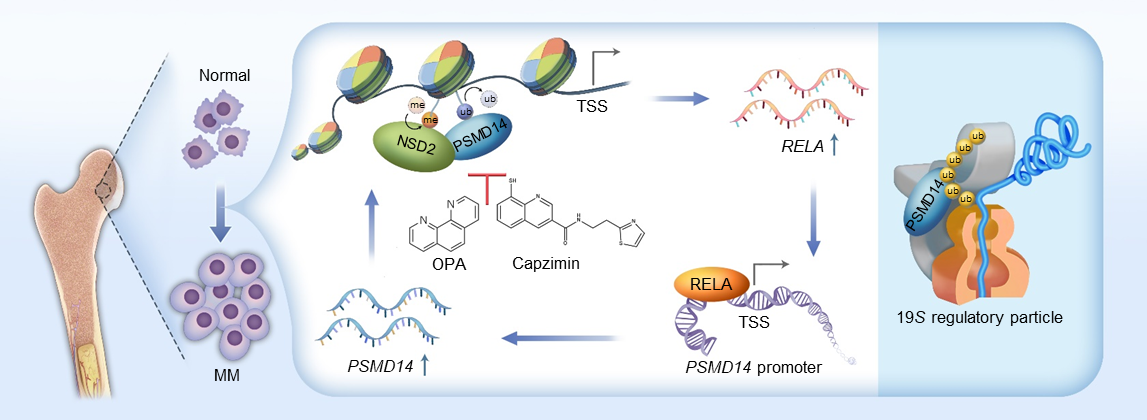
图2. PSMD14/NSD2-RELA正反馈环路驱动多发性骨髓瘤发生发展模式图
进一步地,PSMD14的小分子抑制剂O-phenanthroline (OPA) 和Capzimin能够抑制多发性骨髓瘤细胞增殖,并且能够克服硼替佐米耐药。当与抗骨髓瘤药物如来那度胺、地塞米松联用时,均有效发挥出协同抗肿瘤作用。最后,研究人员对临床数据(n=" 858) 进行分析,发现PSMD14表达水平随骨髓瘤的疾病进展而升高,PSMD14与NSD2共高表达的患者,其预后显著差于两者共低表达的患者,PSMD14可增加中高危骨髓瘤患者的预后分层。
综上,该研究揭示了蛋白酶体固有组分PSMD14未知的表观调控功能,阐明了组蛋白H2AK119去泛素化促进H3K36二甲基化的生化基础,为抑制NSD2活性及其药物开发提供新思路,为多发性骨髓瘤临床耐药提供新的干预靶点和分子分层依据。
yl9193永利何林副研究员为本文的第一作者,孙露洋教授为通讯作者。杭州师范大学尚永丰院士、山东省肿瘤医院刘志强教授、北京大学人民医院血液科路瑾教授和青岛市市立医院血液科钟玉萍教授为本研究提供指导与大力支持。本研究受到科技部、国家自然科学基金和北京市自然科学基金等资助。
孙露洋教授团队主要从事基因转录的表观遗传调控研究,团队详情请见:/jsdw/bssds/Luyang_Sun.html。本团队目前在招聘博士后与科研助理,欢迎推荐加盟。有意者请将个人简历等材料发至:epigenetics_bjmu@outlook.com

