永利官网
PNAS | Th17应对氧化应激的新机制
近日,北京大学张毓&王巍团队在PNAS上在线发表了题为“The PRAK-NRF2 axis promotes the differentiation of Th17 cells by mediating the redox homeostasis and glycolysis.”的研究论文。该文章论述了PRAK是Th17中关键的抗氧化应激调节分子,而干预氧化应激可显著改善Th17细胞的糖酵解代谢,提升Th17介导的抗肿瘤免疫。

氧化应激(Oxidative Stress,OS)是反应性活性氧(Reactive oxygen species,ROS)在胞内过度累积的现象,可严重干扰免疫细胞的正常生理功能,促进局部高炎症反应和肿瘤免疫逃逸。因此,预防氧化应激、维持胞内氧化还原平衡是机体免疫系统正常运转的基础。Th17是一种CD4+辅助性T细胞,在炎症反应和肿瘤免疫中发挥调控作用时依赖糖酵解代谢。目前研究表明Th17的分化与ROS息息相关,但Th17如何应对炎症和肿瘤中的氧化应激,以及是否可通过干预ROS-Th17的方式改善机体免疫状态,仍有待进一步探究。
为研究氧化应激与Th17细胞抗肿瘤功能的关系,研究者首先通过分析CD4+T细胞体外分化模型,发现Th17中PRAK表达较高, 而在T细胞中敲除PRAK(KO)可显著抑制Th17体外分化,与此同时其他Th细胞的终末分化水平没有明显变化。与体外分化的结果一致,在T细胞中特异敲除PRAK可以有效减轻实验性脑脊髓炎模型(Experimental encephalomyelitis,EAE)模型中Th17介导的炎症反应。该团队之前的工作表明PRAK缺陷可导致中性粒细胞和巨噬细胞发生氧化应激。在这项工作中,他们同样发现PRAK缺陷会导致Th17的胞内ROS显著升高,而清除胞内ROS,可显著挽救PRAK缺陷导致的Th17分化障碍。
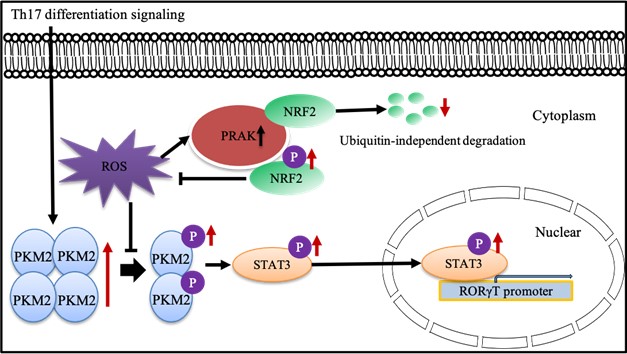
机制上,该研究发现PRAK可直接结合NRF2蛋白,通过磷酸化NRF2 558位丝氨酸促进其蛋白稳定性,因而促进胞内ROS的清除。这一过程并不依赖经典的泛素-蛋白酶体途径,是一种全新的NRF2蛋白降解的方式。而PRAK缺陷诱发的氧化应激将显著下调Th17的糖酵解水平和糖酵解关键酶分子表达。其中,PRAK缺失状态下关键酶分子PKM2磷酸化和聚体形式的改变是抑制转录因子STAT3的磷酸化和入核作用,进而抑制Th17分化的关键。
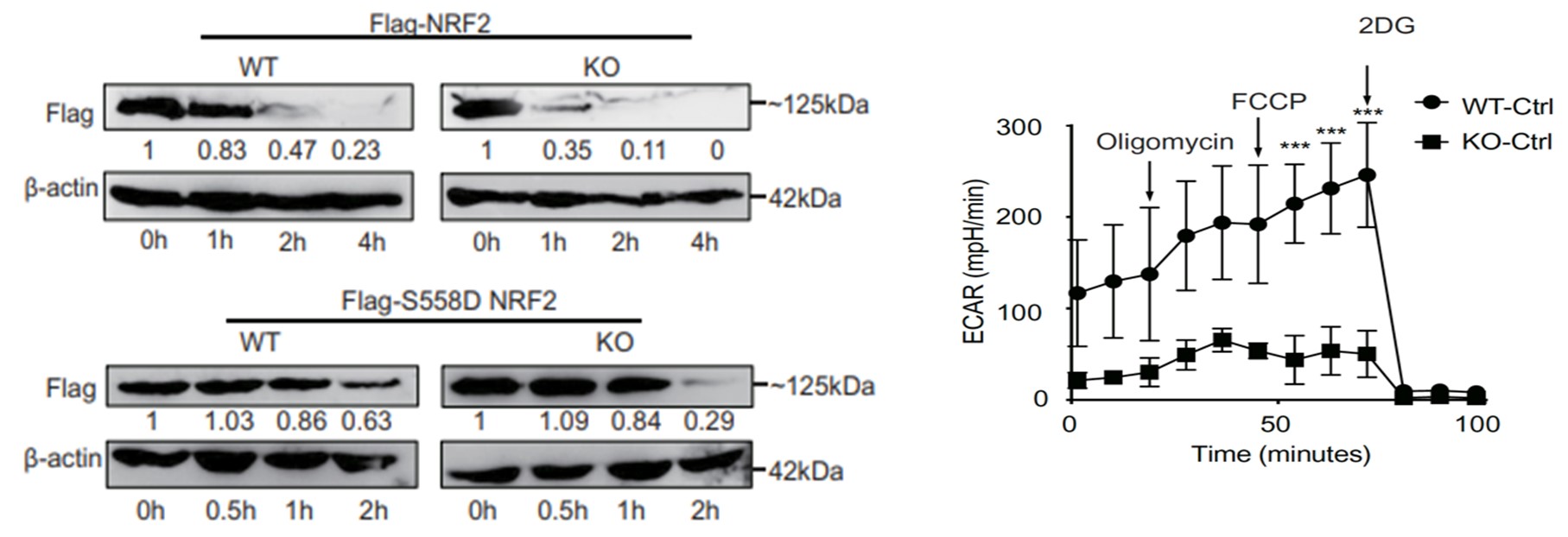
最后,研究者在MC38小鼠皮下荷瘤模型中论证了PRAK缺陷小鼠中Th17的抗氧化应激以及糖酵解的缺陷,将使得Th17细胞介导的抗肿瘤免疫效应显著降低。采用NAC清除ROS可挽救PRAK缺失导致的抗肿瘤效应。
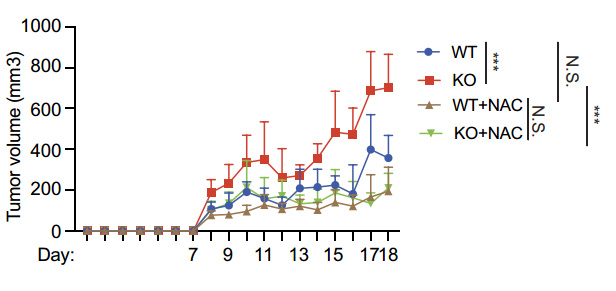
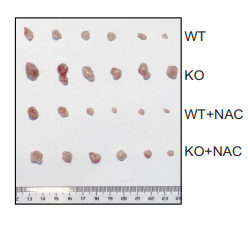
综上,该研究首次发现了PRAK磷酸化NRF2促进其蛋白稳定性的非经典途径。此研究证实了氧化应激压力可以通过改变糖酵解代谢水平和关键酶分子表达的方式调节Th17细胞在肿瘤中的保护作用,并指出ROS的清除有助于Th17介导的抗肿瘤免疫。在肿瘤微环境中,对代谢物功能的研究和调节,将是改良T细胞功能、提高临床免疫治疗的重要环节之一。
本研究获得国家自然科学基金、北京市自然科学基金、北京大学临床医学+X青年专项资助。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2212613120.
论文并列第一作者:yl9193永利博士研究生赵子恒和博士毕业生王妍(现在山西医科大学工作)


(赵子恒) (王妍)
论文通讯作者:
 王巍,副教授,博士生导师。毕业于yl9193永利免疫学系,基础八年制。2009年起任职于yl9193永利免疫学系。长期聚焦代谢—免疫交互调控的问题,重点关注肿瘤和炎症组织中代谢微环境的改变对T细胞的功能调节和重塑,发现了 ROS和乳酸、脂滴对T细胞多种功能的网络式调控。作为第一或通讯作者(含共同)在Nat.Immunol、Sci.Immunol、PNAS等杂志中发表SCI论文十余篇,单篇最高他引400余次,研究工作写入1部丛书。先后主持国家自然科学基金,北京市自然科学基金以及国家重点研发基金等多个项目。
王巍,副教授,博士生导师。毕业于yl9193永利免疫学系,基础八年制。2009年起任职于yl9193永利免疫学系。长期聚焦代谢—免疫交互调控的问题,重点关注肿瘤和炎症组织中代谢微环境的改变对T细胞的功能调节和重塑,发现了 ROS和乳酸、脂滴对T细胞多种功能的网络式调控。作为第一或通讯作者(含共同)在Nat.Immunol、Sci.Immunol、PNAS等杂志中发表SCI论文十余篇,单篇最高他引400余次,研究工作写入1部丛书。先后主持国家自然科学基金,北京市自然科学基金以及国家重点研发基金等多个项目。
 张毓,教授,博士生导师。毕业于第四军医大学,加拿大多伦多大学生物物理学博士,2004年起任职于yl9193永利免疫学系。长江学者、国家自然科学基金委杰出青年获得者、973项目首席科学家。长期从事淋巴细胞发育的研究,发现了多个新的淋巴细胞发育调控分子,揭示了胸腺退化的触发机制和生理意义。近年来,实验室积极拓展肿瘤免疫方面的研究,包括新的肿瘤相关抗原的鉴定、肿瘤微环境免疫抑制特性的解析、胸腺功能与抗肿瘤免疫等。主持多项国家及部委级课题和国际合作研究。
张毓,教授,博士生导师。毕业于第四军医大学,加拿大多伦多大学生物物理学博士,2004年起任职于yl9193永利免疫学系。长江学者、国家自然科学基金委杰出青年获得者、973项目首席科学家。长期从事淋巴细胞发育的研究,发现了多个新的淋巴细胞发育调控分子,揭示了胸腺退化的触发机制和生理意义。近年来,实验室积极拓展肿瘤免疫方面的研究,包括新的肿瘤相关抗原的鉴定、肿瘤微环境免疫抑制特性的解析、胸腺功能与抗肿瘤免疫等。主持多项国家及部委级课题和国际合作研究。

