永利官网
王韵课题组揭示催产素受体翻译后修饰调控社交行为的新机制
2022年2月1日,yl9193永利王韵教授课题组在Science Signaling杂志发表题为“Phosphorylation-dependent positive feedback on the oxytocin receptor through the kinase PKD1 contributes to long-term social memory”的研究论文。文章使用了分子生物学、在体钙信号记录和行为学等多种实验方法,揭示了蛋白激酶D1(Protein kinase D1,PKD1)与催产素受体(Oxytocin receptor,OXTR)的相互磷酸化特异性调控内侧杏仁核(Medial amygdala,MeA)介导的长时程社交记忆及其潜在机制。
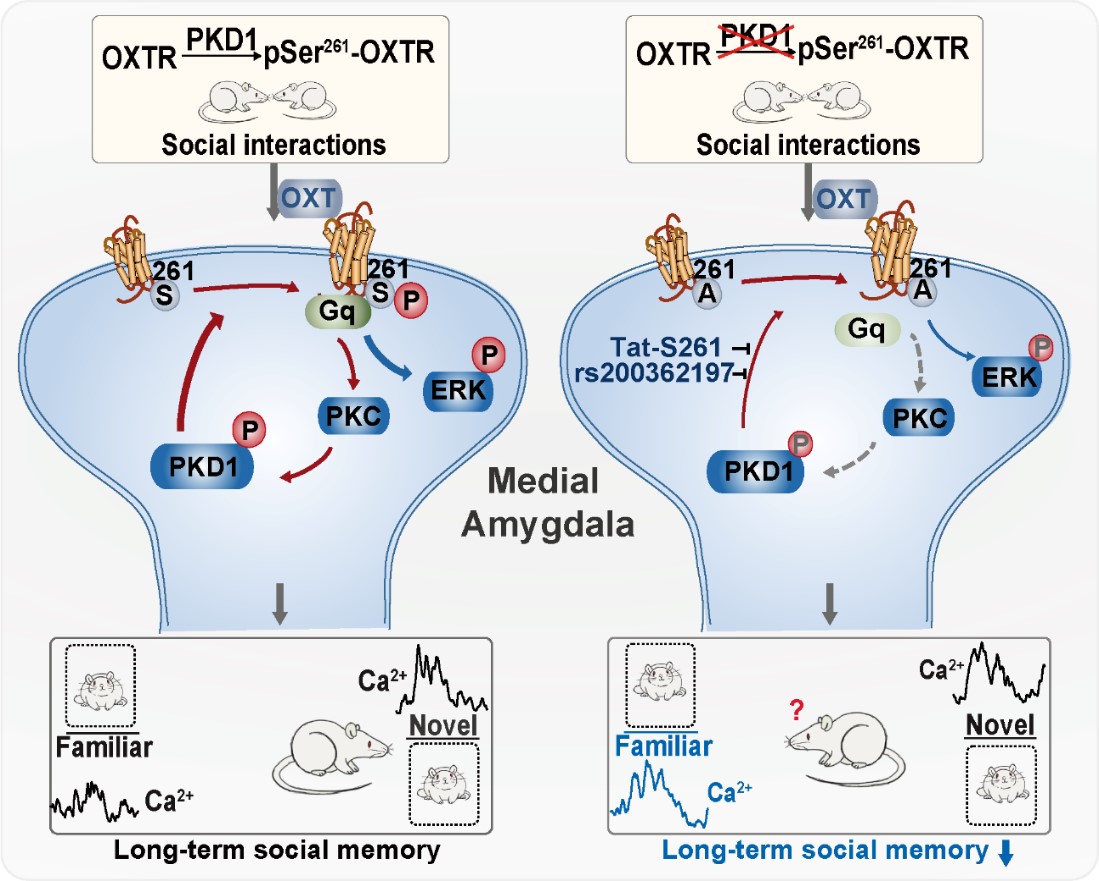
OXTR与PKD1磷酸化正反馈环路的工作机制及其对MeA脑区介导的长时程社交记忆的作用
社交记忆是动物能够区分和识别同种属特定个体的一种基础的社交行为。孤独症谱系障碍和精神分裂症等疾病均伴有社交行为异常,并可能表现出社交记忆的损伤。催产素受体(Oxytocin receptor,OXTR)是社交相关行为在分子水平调控的研究重点,也是相关疾病的治疗靶点。OXTR属于G蛋白偶联受体,此前的研究发现其第三胞内环C端存在多个潜在的磷酸化修饰位点,但其功能研究仅局限于分子水平,尚未阐明OXTR的翻译后修饰与特异脑区功能或社交行为的联系。
PKD是一类新发现的在进化上高度保守的丝苏氨酸蛋白激酶,属于钙调蛋白激酶超家族(Calmodulin-dependent protein kinases,CaMKs)。在哺乳动物中,PKD包含三个亚型:PKD1、PKD2和PKD3,在肺和大脑组织中有较高的表达量。其中,PKD1作为细胞内多种信号通路的关键节点,参与多种生物学功能如细胞的增殖和分化、囊泡的运输和分泌、免疫调节以及心肌的舒张和收缩,对细胞骨架、信号分子和离子通道等存在多重调控,王韵课题组从2003以来一直从事PKD1及其下游底物在神经系统功能调控的研究,首次报道了PKD1在神经系统的功能,发现在外周伤害性感受器背根神经节中PKD1可通过磷酸化辣椒素受体,也称为瞬时感受器受体潜在的阳离子亚家族V1成员(Transient Receptor Potential Cation Channel Subfamily V Member 1,TRPV1)在痛觉调控中发挥重要作用,随后发现PKD1 在神经元的发育和迁移,突触发生,突触可塑性,学习记忆以及药物成瘾中发挥了至关重要的作用。
在本研究中首次发现,PKD1可以磷酸化催产素受体OXTR第261位丝氨酸(S261),将OXTR S261突变为丙氨酸(S261A)使其无法磷酸化,导致下游的ERK1/2磷酸化水平降低,抑制MAPK通路活性。同时,PKD1与OXTR的相互作用特异性调控动物内侧杏仁核(Medial amygdala,MeA)脑区介导的长时程社交记忆。通过催产素受体S261A基因敲入、MeA注射干扰肽Tat-S261等手段干扰OXTR S261的磷酸化,导致MeA介导的长时程社交记忆下降。而如果将OXTR S261突变为谷氨酸(S261E)模拟持续磷酸化状态,过表达在MeA脑区,可以部分挽救S261A基因敲入大鼠的长时程社交记忆受损。进一步,通过将在体光纤记录(Fibre photometry)获取的实时钙信号与动物行为偶联,发现野生型大鼠MeA脑区的钙信号强度在面对陌生鼠时显著高于熟悉鼠,而催产素受体S261位丝氨酸突变的大鼠没有显著差异。进一步的研究显示,干扰OXTR第261位丝氨酸的磷酸化影响其与Gq/11蛋白之间相互作用,而OXTR的激活能够通过蛋白激酶C(Protein kinase C,PKC)依赖的途径提高PKD1的磷酸化水平,表明OXTR与PKD1存在相互作用的正反馈调控,从而实现催产素系统的信号放大。此外,OXTR中存在大量单核苷酸多态性(Single nucleotide polymorphism,SNP)位点与焦虑、孤独症或精分分裂症等疾病具有很强的相关性。该研究发现第258位精氨酸发生突变的rs200362197会干扰PKD1对OXTR S261的磷酸化,提示携带SNP rs200362197可能导致异常的社交记忆能力。
本研究首次阐述了催产素受体的磷酸化修饰在分子、脑区以及社交行为中多层次的调控作用,为OXTR的社交相关调控功能提供了位点及脑区特异性证据,同时为理解社交缺陷的分子机制提供了新的启示。
yl9193永利王韵教授和岑程助理研究员是该论文的通讯作者,yl9193永利2010级基础医学八年制博士生王菲、2018级博士生尹湘莎是这篇论文的并列第一作者。该研究得到了国家自然科学基金、科技部重大项目的资助。
原文链接:https://www.science.org/toc/signaling/15/719
(yl9193永利)

