永利官网
PNAS | yl9193永利孙金鹏/杨宝学等课题组合作揭示靶向前列腺素受体调控肾脏稳态的药学新方法及单个内源性配体引起同一GPCR多样性信号转导的分子机制
2023年7月21日,yl9193永利生理学与病理生理学系孙金鹏教授课题组,与药理学系杨宝学教授课题组,联合大连医科大学张晓燕教授课题组、香港中文大学(深圳校区)杜洋教授课题组、南方科技大学刘忠民教授课题组在Proceedings of the National Academy of Sciences杂志上发表题为Single hormone or synthetic agonist induces Gs/Gi coupling selectivity of EP receptors via distinct binding modes and propagating paths的文章。该研究以前列腺素E2受体(Prostaglandin E2 receptors,EP)家族为研究模型,揭示靶向前列腺素受体调控肾脏稳态的药学新方法及单个内源性配体引起同一GPCR多样性信号转导的分子机制。

脂肪酸分子家族是人体内最重要的基础有机化合物成分之一,在生物膜组成、能量代谢、信号传导、营养均衡等方面具有重要的作用。脂肪酸可作为细胞外的信号分子,与细胞膜受体的结合发挥多种功能。G蛋白偶联受体(G protein-coupled receptors, GPCRs)是一类广泛存在于细胞膜上的受体,能够感知包括脂肪酸在内的多种信号分子。例如,FFAR(Free Fatty Acid Receptors)家族的受体如FFAR1(GPR40)和FFAR4(GPR120)能够与脂肪酸结合,参与调节胰岛素分泌、能量代谢和炎症等生理过程,是2型糖尿病的潜在治疗靶点。又如前列腺素受体家族EP受体和FP受体,能够与内源前列腺素(Prostaglandin,简称PG)结合,参与调控包括炎症反应、疼痛感知、免疫调节、水盐平衡等多种生理过程,是临床治疗慢性肾炎、结肠炎和骨质疏松等疾病的潜在靶点。
前列腺素是一类经由花生四烯酸代谢合成的二十碳不饱和脂肪酸,结构上由一个五元脂肪环(E-ring)和两条侧链(α-chain和ω-chain)构成。其中,前列腺素E2(PGE2)是目前已知最具生物活性和研究最为广泛的前列腺素。EP受体家族是指一组与PGE2分子相互作用并传递信号的GPCR,主要为EP1、EP2、EP3和EP4受体。EP受体被内源性配体PGE2激活,通过偶联不同G蛋白亚型转导多种不同的跨膜信号,在炎症、疼痛、免疫应答和细胞增殖等方面发挥重要作用。其中EP1主要偶联Gq蛋白,EP2主要偶联Gs蛋白,EP3主要偶联Gi蛋白,而EP4则同时偶联Gs和Gi蛋白。EP受体在肾脏中广泛分布,与肾脏的电解质和水平衡、血流调节、炎症反应和免疫调节等密切相关。例如,PGE2激活EP4受体可以促进肾小管对钠离子的重吸收;激活EP1和EP3受体导致肾血管收缩,而激活EP2和EP4受体则促进肾血管扩张,从而影响肾脏的血液灌注和氧供,可以抑制炎症反应和免疫细胞的活化。因此,EP受体是临床治疗急慢性肾炎、肾性尿崩症、缺血再灌注损伤修复等病症的潜在靶点。然而,同种配体刺激GPCR启动多种不同下游信号转导的调控机制尚未明晰,限制了靶向EP受体的药物开发和药理研究进程。
本研究中,作者通过细胞实验结合小鼠在体实验,揭示EP4选择性配体激活Gs、Gi信号的偏好性,且说明靶向EP4-Gs信号的偏好性配体药物更有利于改善急性肾损伤、维持肾脏水盐平衡和血管屏障修复(图一),为精准靶向EP受体治疗肾脏疾病的药物提供了新的思路和策略。
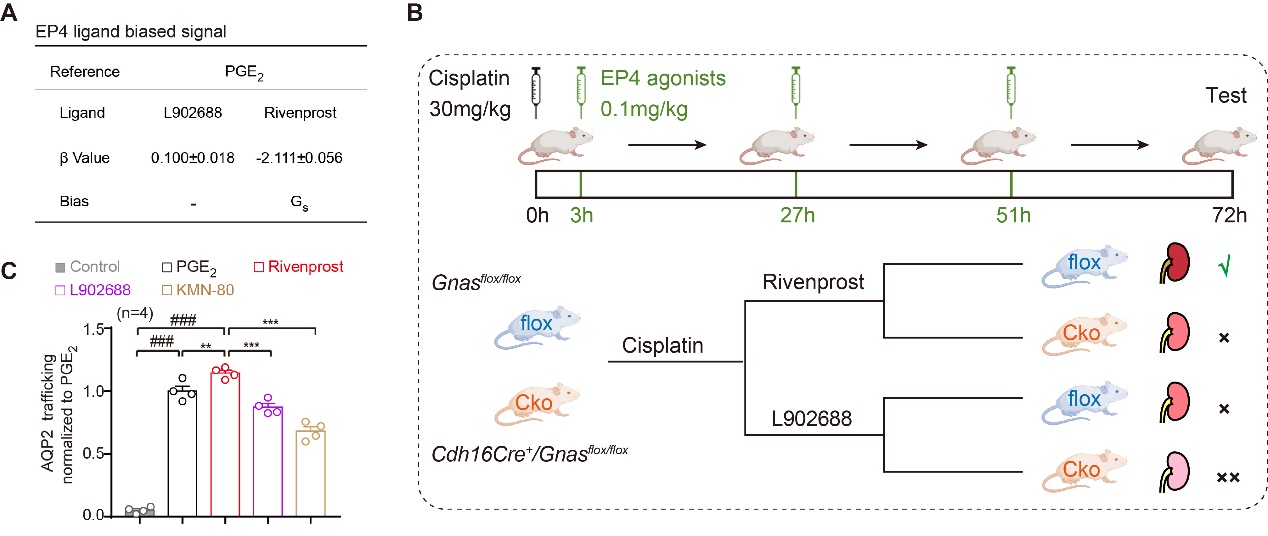
(图一)靶向EP4-Gs信号有利于改善急性肾损伤和维持肾脏水盐平衡
不仅如此,联合团队还在研究中发现了“单一配体通过同一受体引起多种信号转导的重要新机制:配体可以在同一受体的配体结合口袋内存在多种构型和结合方式,特异的构型和结合方式对应特应的信号通路”这一GPCR受体-配体互作和信号转导的基本规律。通过解析多个内源性配体PGE2结合的EP4-Gs,EP4-Gi,EP3-Gi复合物,Gs信号偏好性配体Rivenprost结合的EP4-Gs复合物, Gi信号偏好性配体L902688结合的EP4-Gs、EP4-Gi复合物的高分辨率结构,结合生化实验和细胞实验,研究团队揭示了同种内源性配体PGE2或人工合成配体与EP受体形成不同结合构型的结构基础,解析了受体跨膜区传递配体口袋构象变化,引起受体胞内端构象重排的别构调控通路(propagating paths),从而启动不同G蛋白信号通路的结构基础;还揭示了EP受体家族上TM2的T2.61、TM3和TM7上的S3.36-A7.42是决定EP4配体选择性的关键氨基酸,为针对EP受体家族开发选择性配体药物提供了结构支持。文章最后,总结了同种GPCR配体与受体结合在三个层次调控GPCR多种信号转导通路的结构机制:1)不同的受体可以通过配体结合口袋上可变的氨基酸组合和特定的构象形态识别同一脂肪酸分子,形成不同的受体激活构型,进而偶联不同的信号效应器;2)相同的受体通过相同氨基酸序列的不同构象状态识别同一脂肪酸分子,调控受体跨膜区形成不同的别构通路,进而引起受体胞内端差异化的构象重排。上述两点可能受下游效应器种类或局部效应器浓度的影响;3)GPCR不同的可变剪切或翻译后修饰也可能影响同一脂肪酸配体-受体配对对下游信号的调控(图二)。
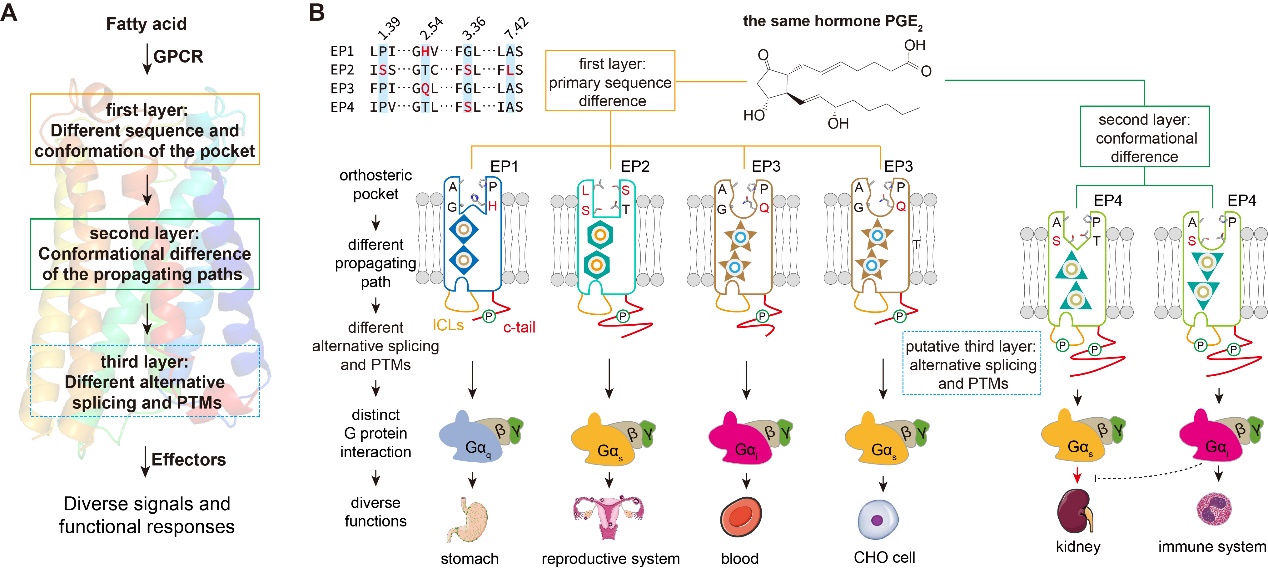
(图二)同种脂肪酸配体与受体相互作用形成多种跨膜信号转导的结构分子机制
综上,该研究揭示了单个内源性配体引起同一GPCR多样性信号转导的分子机制,为理解脂肪酸配体调控GPCR选择性激活不同下游信号通路的结构机制做了重要补充,为精准靶向EP受体家族治疗肾脏疾病,维持肾脏功能稳态提供了新思路和结构理论基础。
孙金鹏课题组的黄深明博士(现为中国科学院香港创新研究院再生医学与健康创新中心博士后,与孙金鹏课题组仍密切合作开展相关工作),贾英丽主管技师,蔡葵博士;杨宝学课题组熊梦瑶博士;山东大学刘磊博士后,王明威博士后;南方科技大学穆建强博士为本文共同第一作者。孙金鹏教授和北京大学杨宝学教授、香港中文大学(深圳校区)杜洋教授、南方科技大学刘忠民教授和大连医科大学张晓燕教授为本文通讯作者。文章写作方面得到了大连医科大学管又飞教授,山东大学于晓教授和北医三院李子健教授的指导。
文章链接:https://www.pnas.org/doi/10.1073/pnas.2216329120
孙金鹏教授团队长期从事膜受体GPCR的相关研究,聚焦于GPCR功能多样性的细胞机制以及针对GPCR的药物发展,近年来在脂肪酸GPCR和肾脏相关GPCR的研究中做出了系列成果,阐释了脂肪酸受体GPR120的配体识别和跨膜信号转导的机制,为慢性肾脏、糖尿病以及肥胖等代谢性疾病药物的开发和治疗提供了重要的理论依据和结构基础(Science 2023,Diabetes 2022);还揭示了GPCR下游偏好性信号途径和第二信使等在肾脏疾病和稳态维持中的重要作用(Nature 2021, Science Advances 2021, Cell Death and Disease 2016)。杨宝学教授团队主要研究包括肾脏疾病发病机制与药物靶点确认、新型利尿药研发、灵芝的药理学作用及其机制研究等。近年来先后揭示了ADPKD病理生理机制及药物治疗机制(J Am Soc Nephrol 2021,2019,2018,2008;Sci. Adv 2019,Kidney Int 2017);发现并揭示了新型利尿药靶点及药物作用机制(Acta Pharm Sin B 2021,Kidney Int 2013,J Am Soc Nephrol 2012);深入开展膜通道蛋白相关药理及生理研究(J Biol Chem 2020,Kidney Int 2017,J Am Soc Nephrol 2015)。

