永利官网
yl9193永利张宏权教授团队在基质生物学领域取得系列重要研究进展
4月13日,yl9193永利人体解剖与组织胚胎学系张宏权教授课题组在国际权威细胞生物学期刊The Journal of Cell Biology发表论文,首次阐明整合素激活调控蛋白Kindlin-2的降解机制,并发现E3泛素连接酶Smurf1通过对Kindlin-2在细胞特定部位的降解而对受体整合素的激活起到负向调控作用这一新功能。论文题目为“Smurf1 inhibits integrin activation by controlling Kindlin-2 ubiquitination and degradation”。课题组魏潇凡讲师和博士研究生王翔为论文共同第一作者,张宏权教授为责任作者。该研究得到军事医学科学院张令强研究员课题组协助。
整合素(Integrins)是一类介导细胞外基质与细胞内微环境物理连接和信息连接的跨膜受体,控制着细胞的粘附、运动、迁移、增殖和凋亡等基本细胞生物学功能,与胚胎正常发育及一系列包括肿瘤在内的重大疾病发生发展密切相关。整合素的激活是生命活动必不可少的,是细胞中最为关键的信号通路。目前已发现的能直接控制整合素激活的蛋白共有两类:包括Talin与Kindlins。
张宏权教授课题组近年来在基质生物学(Matrix Biology) 领域取得系列重要研究突破,系统阐述了整合素激活调控蛋白Kindlin-2在发育、肿瘤和器官纤维化中的重要作用及在抗肿瘤和治疗肾纤维化中的重要应用前景。迄今发表了23篇有关Kindlin-2的系列SCI论文,获选2016年北京市十二五重大科技成果。
本次发表长达17页的论文揭示出重要的E3泛素连接酶Smurf1 可以通过促进Kindlin-2 蛋白泛素化和蛋白酶体降解调控整合素的激活,从而影响一系列整合素介导的细胞生物学功能。利用基因敲除鼠和临床病人标本,课题组在体内证实了Smurf1对Kindlin-2的降解作用。该工作拓展和深化了整合素激活的调节机制,并通过揭示Smurf1 的新功能提出Smurf1 在发育及肿瘤中发挥作用的可能机制是通过调控Kindlin-2 的蛋白量及整合素的激活。更为重要的是,解析Kindlin-2蛋白稳定性调控的机制将有助于开发相关药物,干预肿瘤及肾脏纤维化的发生和进展。
另外,该工作对前期《自然细胞生物学》杂志(Huang,et.al, NCB, 2009)的一项报道提出质疑和挑战。通过大量研究数据,课题组提出NCB所报道的“Smurf1介导整合素激活蛋白Talin头部降解”的结论是错误的,指出Smurf1在各种试验过的细胞系中以及动物体内均不能介导Talin头部及全长分子的降解。这一结论得到JCB杂志资深编辑和论文审稿人的认同,论文同时获得高度评价。
该工作得到了国家自然科学基金重点和面上项目、科技部“973”计划项目及北京市自然科学基金重大项目的资助。
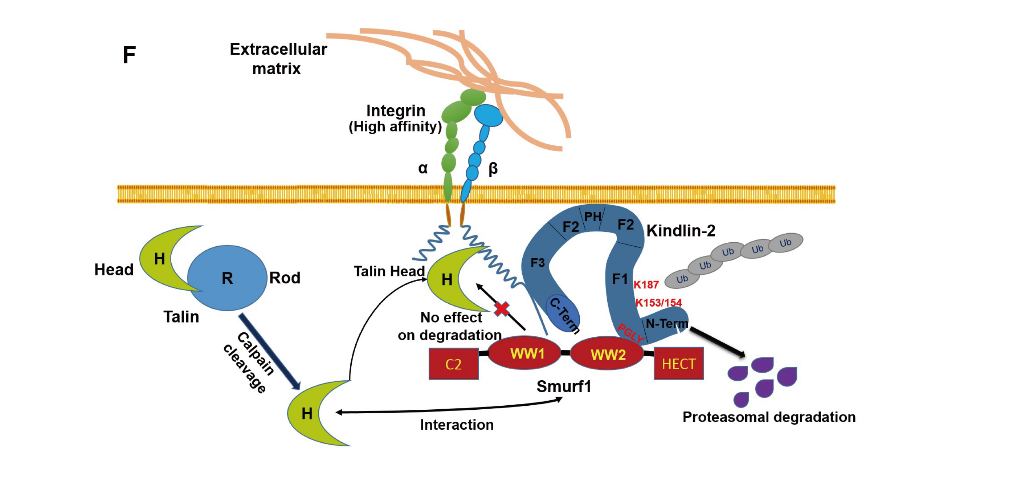
Smurf1通过泛素化介导Kindlin-2降解抑制整合素激活的分子机制
论文链接:http://jcb.rupress.org/content/early/2017/04/12/jcb.201609073
(yl9193永利)

